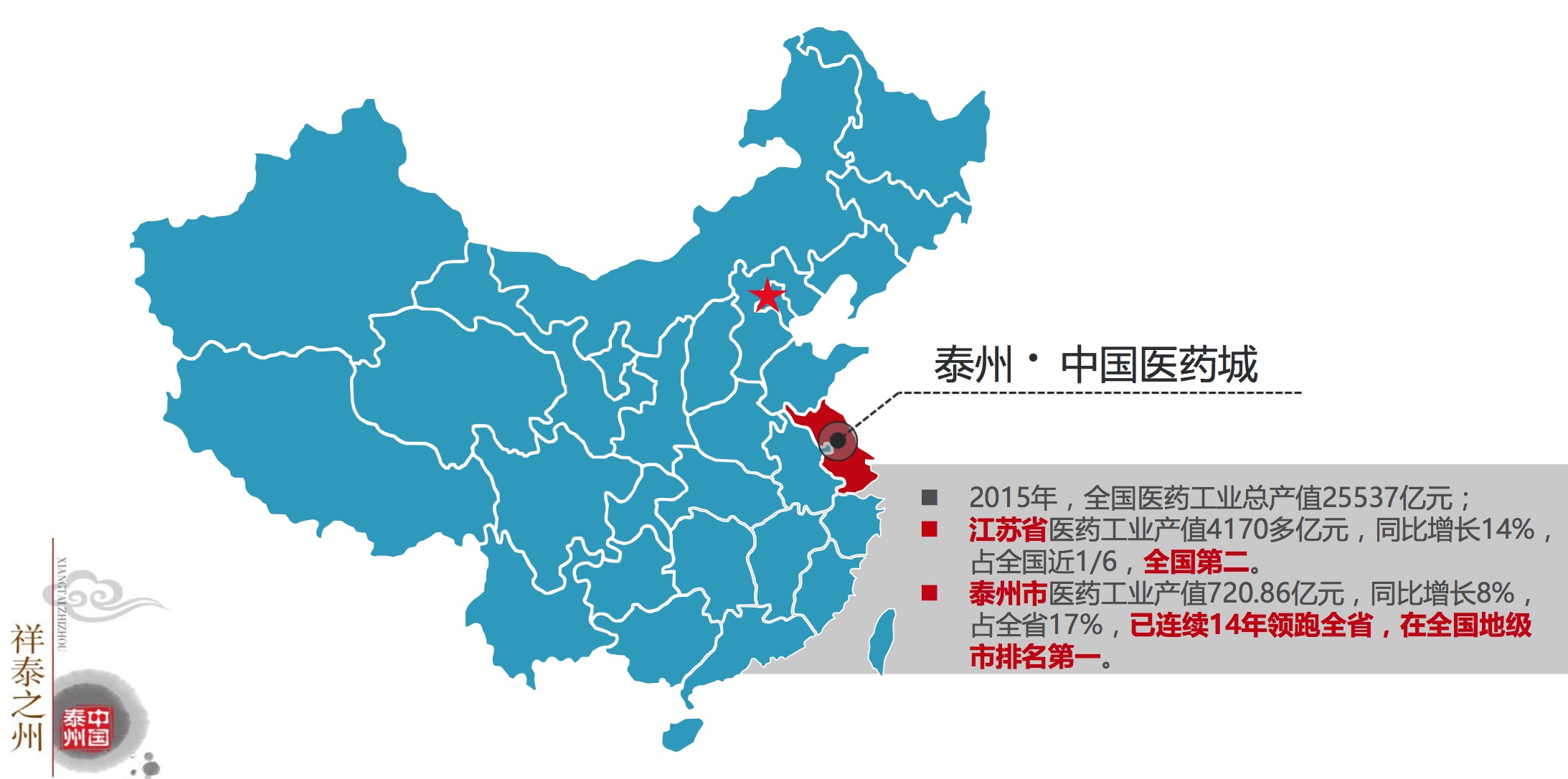
产业背景
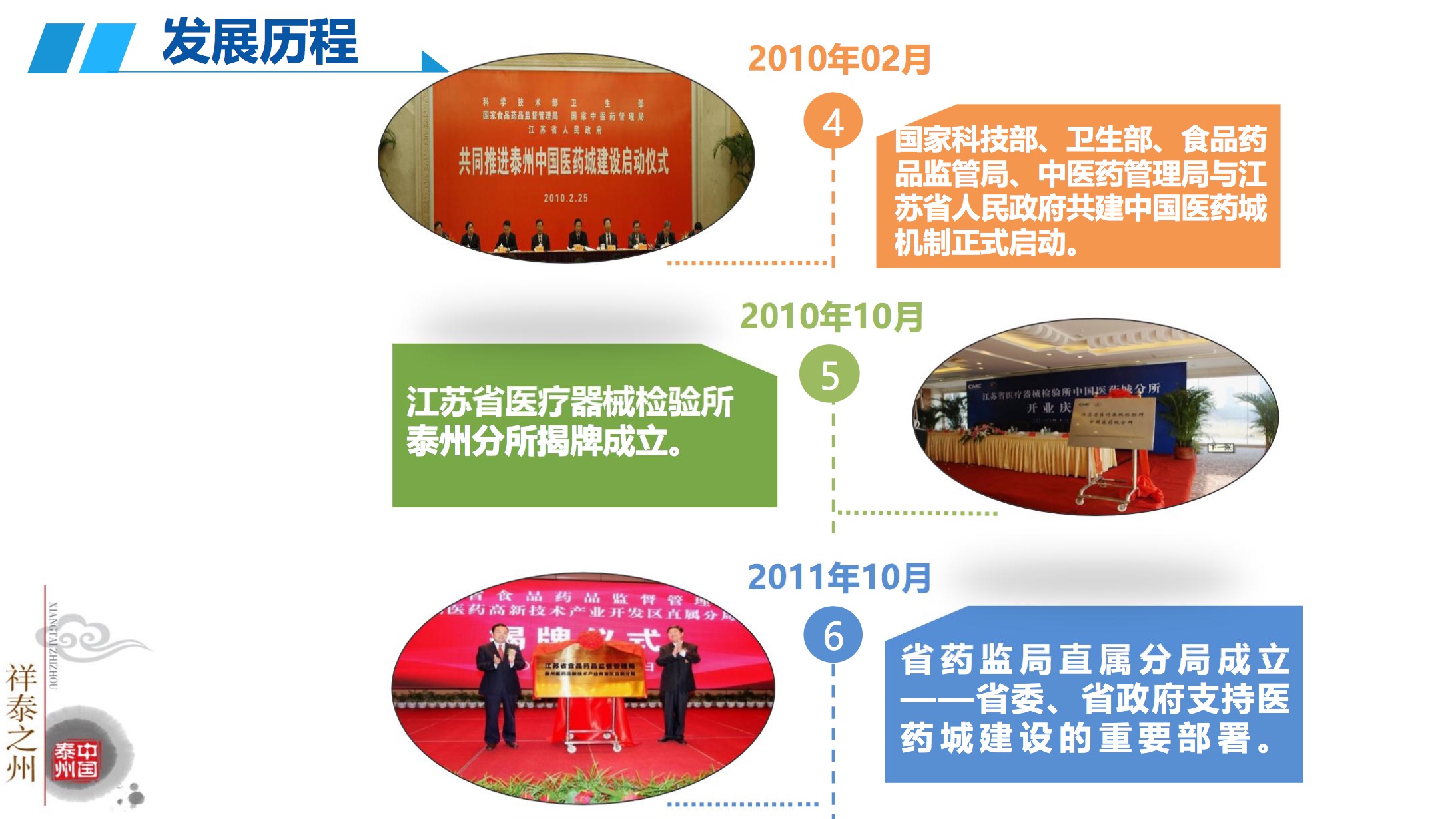
发展历程(一)

发展历程(二)
药品研发及生产企业132家
- 已取得生产许可证30家,14家37条生产线通过GMP认证
- 已取得药品经营许可证25家,通过新版GSP认证25家
- 拥有各类药品品种560个,其中一类新药56个
- 已获生产批件95个,临床批件131个,已申报在审品种60 余个
医疗器械研发生产企业262家
- 已取得医疗器械生产许可证80家
- 目前在研和申报品种共1214个。已获注册或备案证602 个(其中二、三类产品269个),正在审评的612个
保健食品/化妆品研发生产企业20家
- 已取得食品生产许可证10家(其中保健食品生产4家)
- 已取得化妆品生产许可证3家
- 已获证保健食品25个,化妆品94个










服务体系
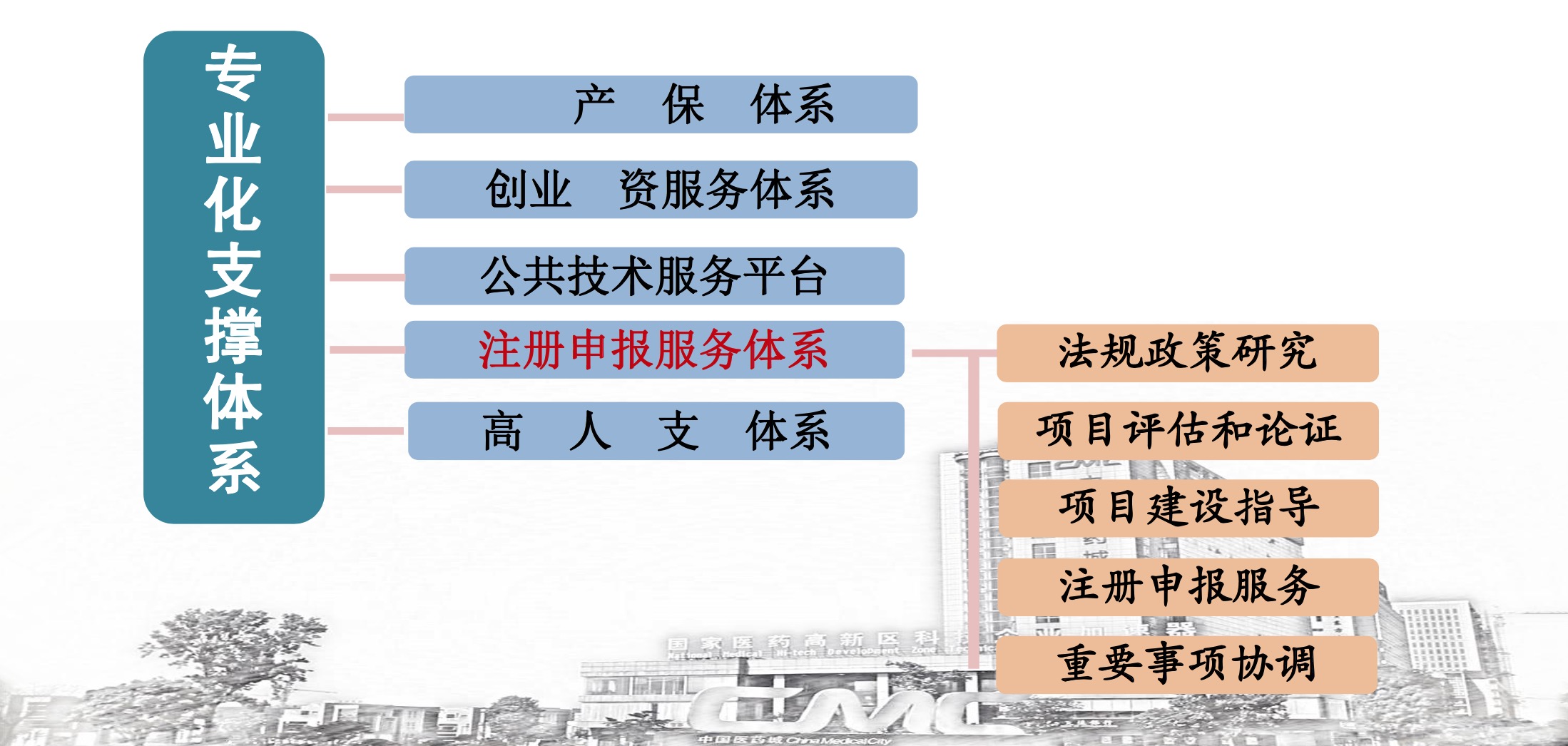
行政许可职能
直属分局的设立实现中国医药城企业点对点的申报服务体系,成为推动中国医药城发展的重要支撑力量,为泰州建设“产城一体的医药名城”增添新的动力
江苏省食品药品监督管理局泰州医药高新区直属分局
- 根据省局授权,承担中国医药城范围内药品,医疗器械,保健食品,化妆品注册及生产经营有关许可职责
- 指导中国医药城范围内"三品一械"生产经营的日常监督管理工作
- 为中国医药城产业发展提供有关服务


行政许可职能
直属分局已开展的行政审批工作
| 行政审批事项名称 | 审批方式 |
|---|---|
| 药品生产许可证核发 | 完全 |
| 医疗器械生产企业许可证(二、三类)核发 | 完全 |
| 药品经营企业许可证核发 | 完全 |
| 医疗器械经营许可证(二、三类)核发 | 完全 |
|
药品注册 (一)药物临床研究的注册申请 (二)新药生产的注册申请 (三)已有国家标准药品注册 | 完全 |
技术审评:技术转让资料参审;二类医疗器械审评参审和注册体系核查复查。
工作举措
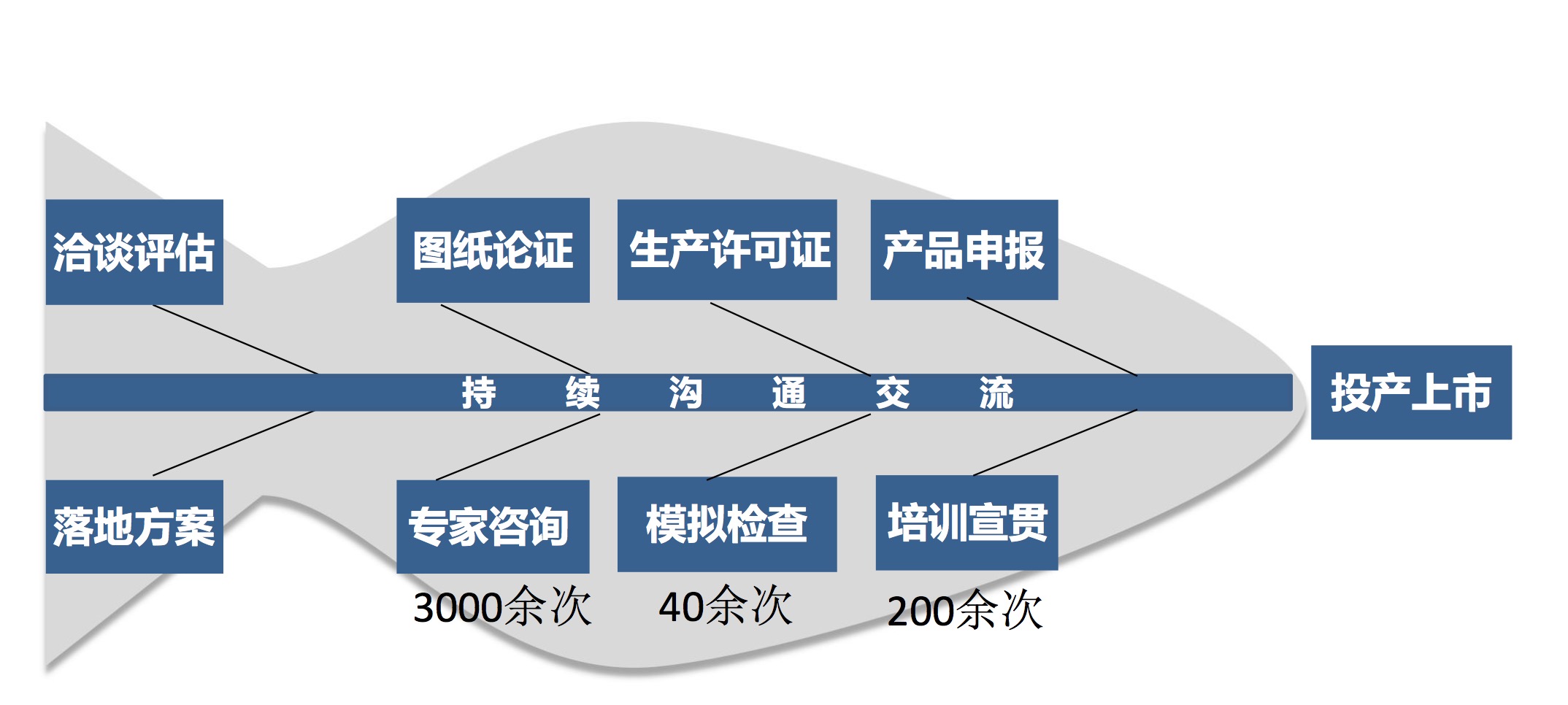
前期指导、全程服务
- 共同研究制定项目落地方案;
- 厂房图纸论证、资料预审;
- 专家现场指导、模拟检查;
- 法规研读、培训宣贯。
沟通交流机制
- 国家部委领导下挂交流机制(科技 部、药监总局、中医药管理局);
- 挂职学习交流机制(科技部、药监 总局、CDE、中检院等);
- CDE审评交流制度(重大专项品种、 创新器械、临床价值评估)。

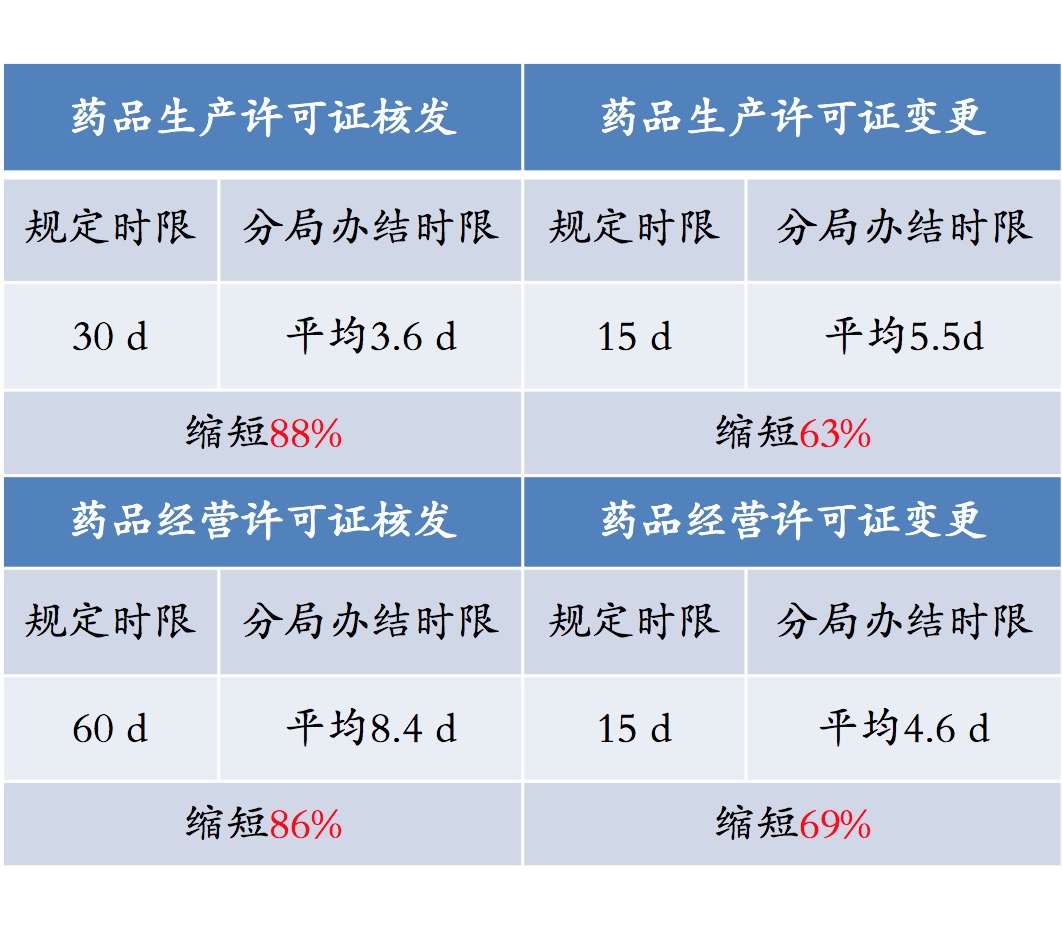
优化流程、压缩时限
- 原则:标准不降、程序不减、速度加快;
- 专家预审、模拟检查;
- 药品、医疗器械审评参审、现场核查;
- 简化环节、合并检查。
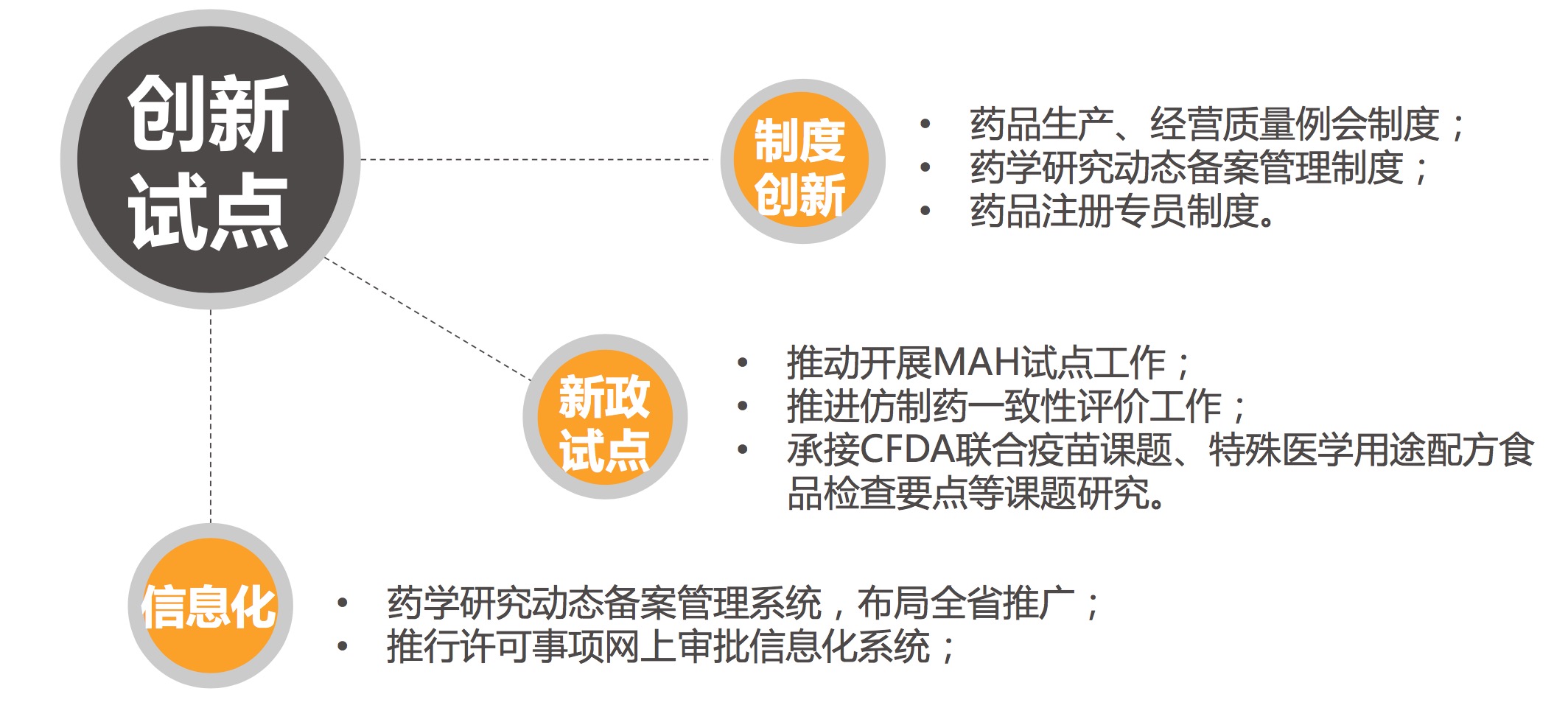
制度创新、试点研究
- 药品注册专员制度;
- 药学研究动态备案管理制度及信息化系统;
- 推行信息化审批系统;
- 药品生产、经营质量例会制度;
- 课题研究、MAH等试点研究。
前期指导、全程服务

大型公益性“仿制药一 致性评价”研讨会

MAH调研座谈会

药品注册专员培训班

GMP培训班
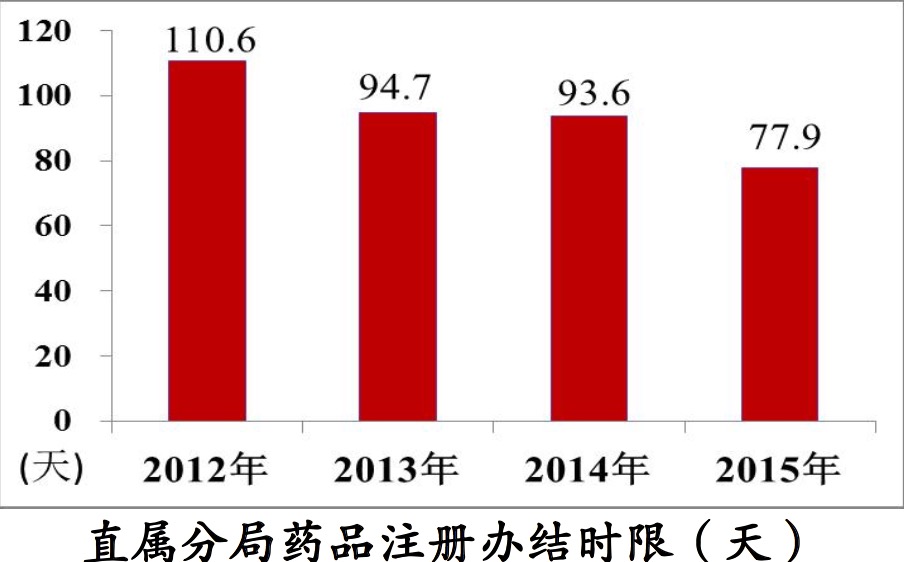
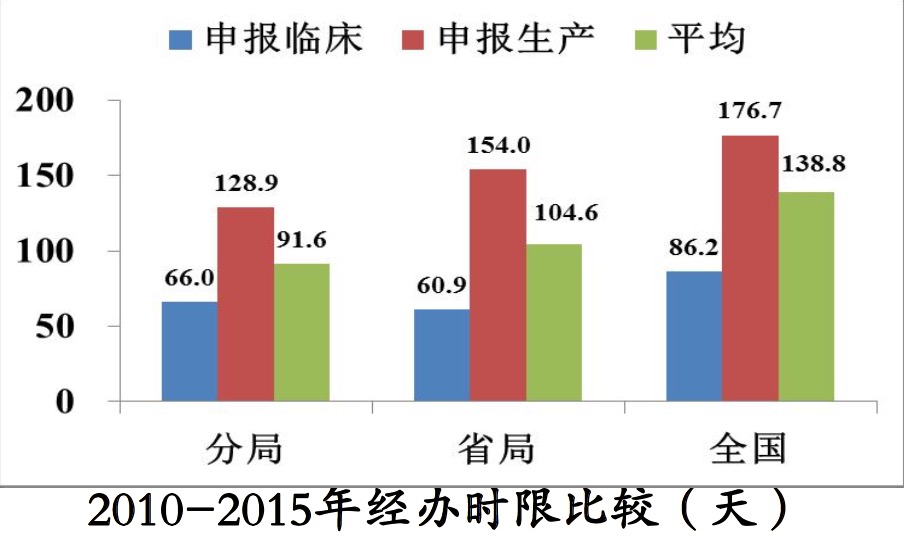
优化流程,压缩时限
制度创新、试点研究
深化部省共建机制
部省共建联席会议制度
- 每年部长级联席会议;每季度联 络员会议。
- 认真研究园区产业发展需求,根 据国家政策导向提出合理诉求
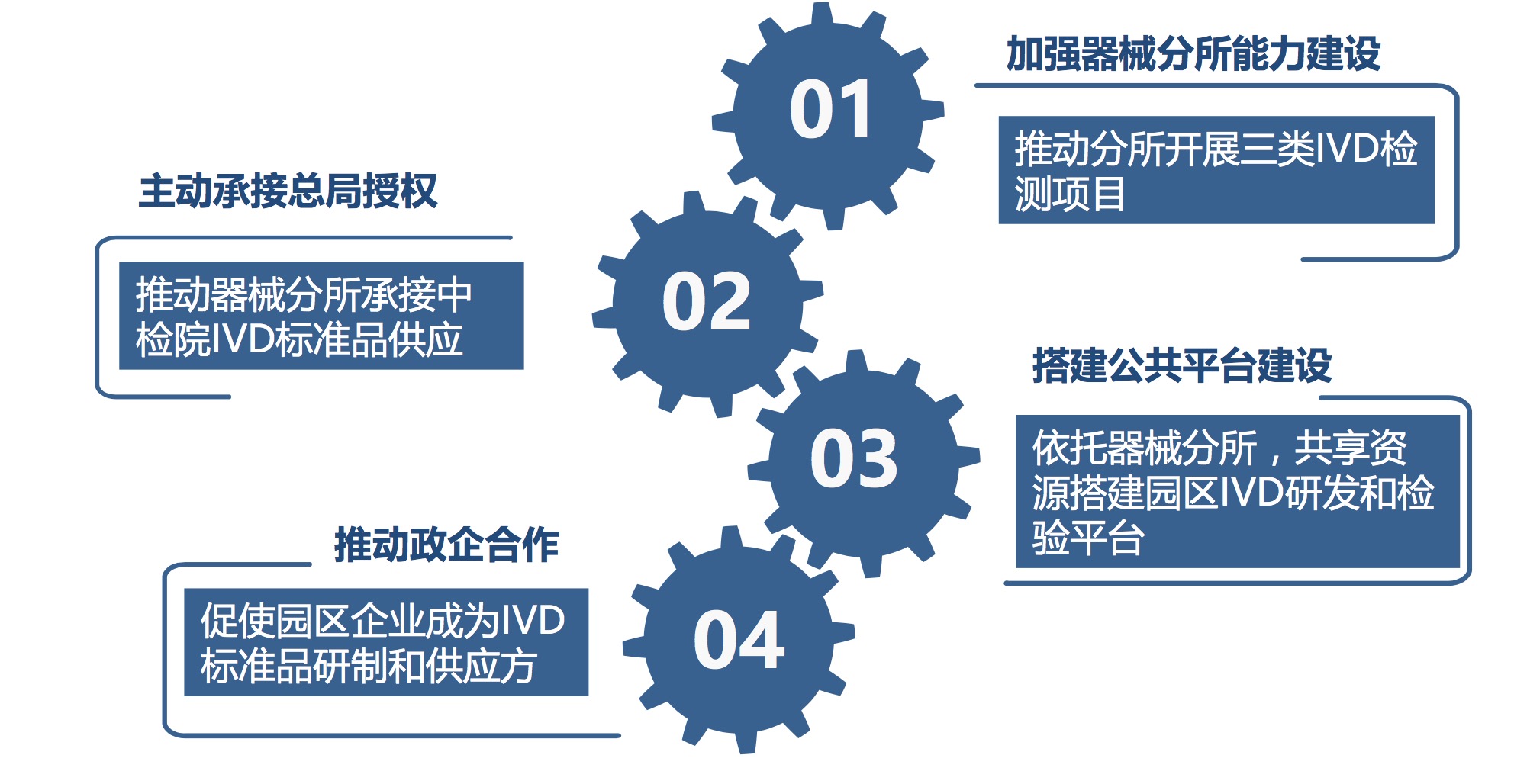
承接国家总局的业务授权
- 推动器械分所与中检院在体外诊断试 剂标准品研制制备供应合作。
- 2016年省器械分所通过CMA&CNAS C 二合一现场审评,具备生化、免疫、 核酸等7类共72项产品及参数的检测 能力。去年承担IVD检验批次和数量 已占全省近一半。
- 推动器械分所开展三类IVD检测项目。
挂职交流
- 国家部委领导下挂交流机制(科技 部、药监总局、中医药管理局);
- 挂职学习交流机制(科技部、药监 总局、CDE、中检院等);
定期沟通,助力审评
- 为甲型肝炎灭活疫苗、甲磺酸萘莫司 他等品种专题协调,加速审评
- 协调推进创新医疗器械申报。
- 特殊医学用途配方食品立法推进。
案例分享-阿斯利康泰州供应基地建成投产
- 动工到通过GMP仅31个月。
- 2015年ISPE国制工程协。



- 共同研究品种转移方案;
- 全程参与AZ泰州工厂图纸设计、指导申报材料;
- 安排专家现场指导,模拟检查;
- 法规合规的前提下,最大程度地缩短品种转移的时间。
- 许可证变更和核发检查合并进行;
- 品种转移验证批与GMP认证批合并。
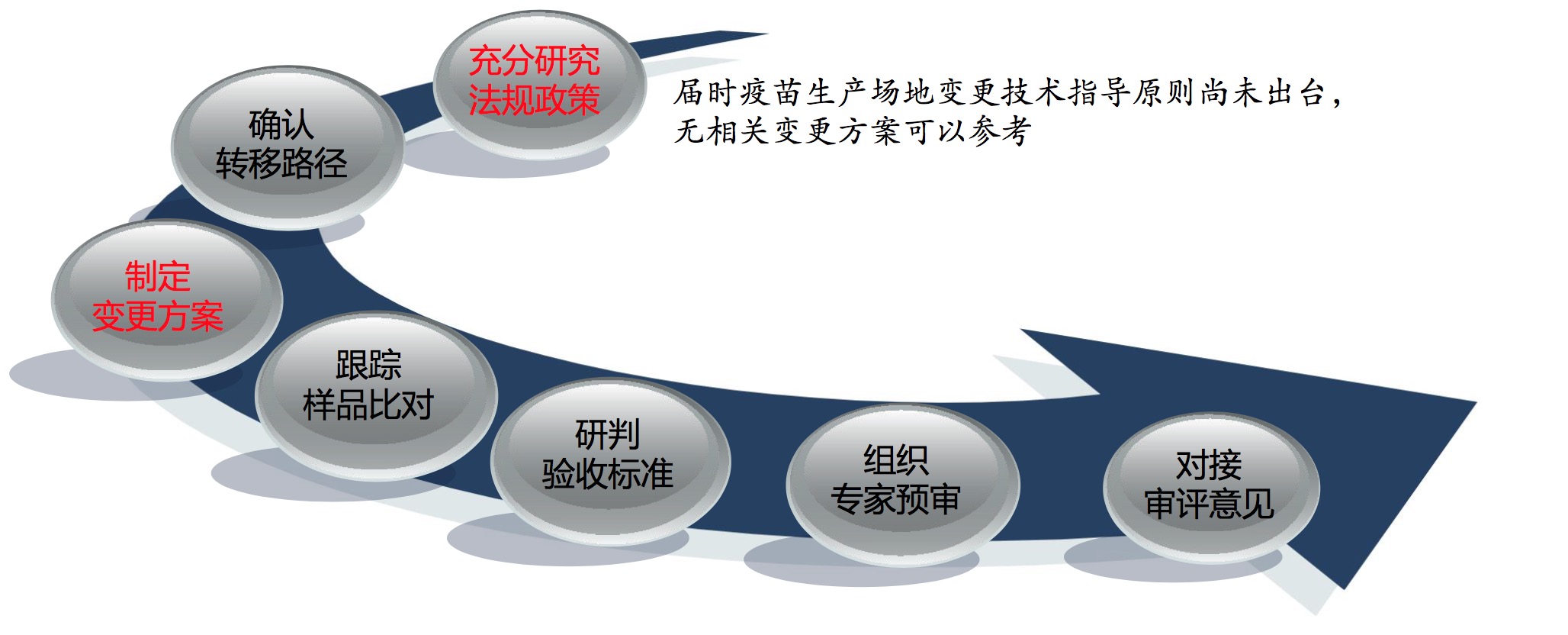
康淮生物甲肝疫苗落地产业化
直属分局主动介入,协调各类监管资源,全程指导和帮扶,产品转移方案审评 高度认可,10个月的时间取得生产批件。
中检院IVD标准品制备合作
其他主要成果
- 君实生物PD1 - 全国首家批临床
- 命码核酸试剂盒 - 全球首创
- 硕世HPV分型定量系统 - 国内首家
- 雀巢中国 - 推动特殊医学用途配方食品立法
- 华为平台 - 药品第三方物流平台

